乳腺癌
Adv. Sci. 2022:酸降解產(chǎn)氫MOF材料克服癌癥耐藥/轉(zhuǎn)移和脫靶副作用

背景
開(kāi)發(fā)既能控制藥物釋放又具有高生物安全性的刺激響應(yīng)性可降解多孔載體對(duì)其臨床轉(zhuǎn)化至關(guān)重要,但目前仍具有挑戰(zhàn)性。本文通過(guò)卟啉與零價(jià)鐵原子的配位,設(shè)計(jì)了一種新型的卟啉-鐵金屬有機(jī)骨架(Fe-MOF)納米晶體,作為酸降解的藥物載體和氫供體。Fe-MOF納米晶體表現(xiàn)出優(yōu)異的酸響應(yīng)降解能力,可以產(chǎn)生氫氣并同時(shí)釋放負(fù)載藥物,用于癌癥多藥耐藥(MDR)和轉(zhuǎn)移的氫聯(lián)合化療,以及局部氫消除藥物對(duì)正常細(xì)胞/組織的脫靶毒副作用。在機(jī)制上,釋放的H2通過(guò)免疫激活瘤內(nèi)M1表型巨噬細(xì)胞,從而下調(diào)轉(zhuǎn)移相關(guān)基質(zhì)金屬蛋白酶-2 (MMP-2)的表達(dá),幫助化療藥物有效抑制腫瘤轉(zhuǎn)移,并下調(diào)MDR癌細(xì)胞中p -糖蛋白(P-gp)蛋白和三磷酸腺苷(ATP)的表達(dá),使化療藥物增敏,增強(qiáng)對(duì)線粒體和DNA的損傷。高抗MDR/抗轉(zhuǎn)移性和高生物相容性使Fe-MOF納米晶體和基于Fe-MOF的納米藥物具有很高的臨床轉(zhuǎn)化潛力。
圖文導(dǎo)讀

(圖1 從DOX@Fe-MOF納米晶體中釋放酸反應(yīng)性氫/藥物以克服癌癥耐藥/轉(zhuǎn)移的示意圖)

(圖2 Fe-MOF納米晶的合成路線及形貌和結(jié)構(gòu))
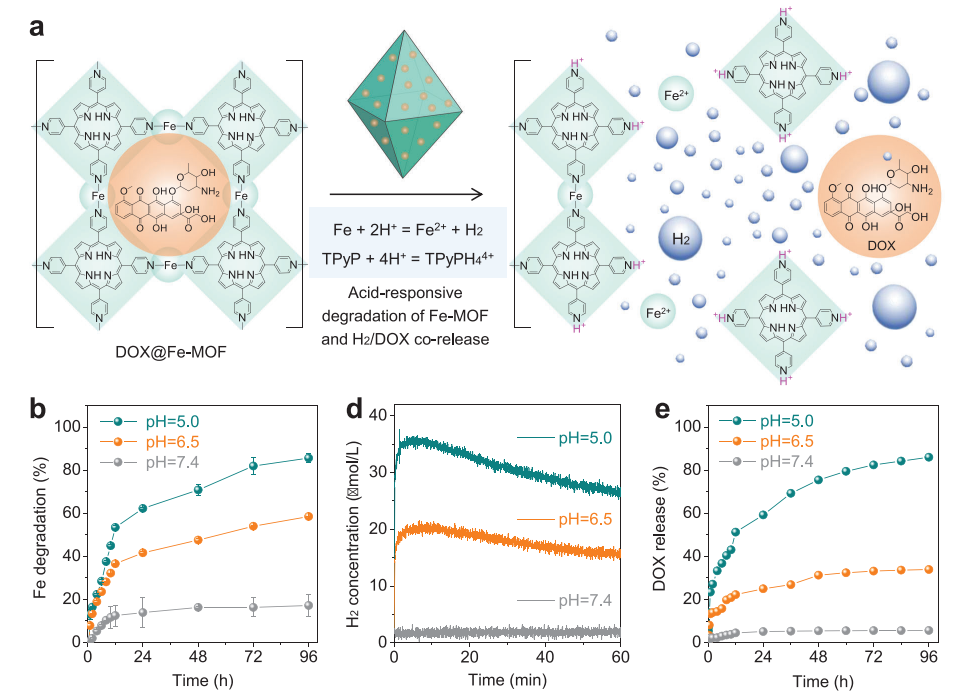
(圖3 酸反應(yīng)性降解和氫/藥物釋放譜)


(圖4 體外氫聯(lián)合化療治療癌癥耐多藥的療效及機(jī)制研究)

(圖5 體內(nèi)氫聯(lián)合化療(n = 5個(gè)獨(dú)立實(shí)驗(yàn)))
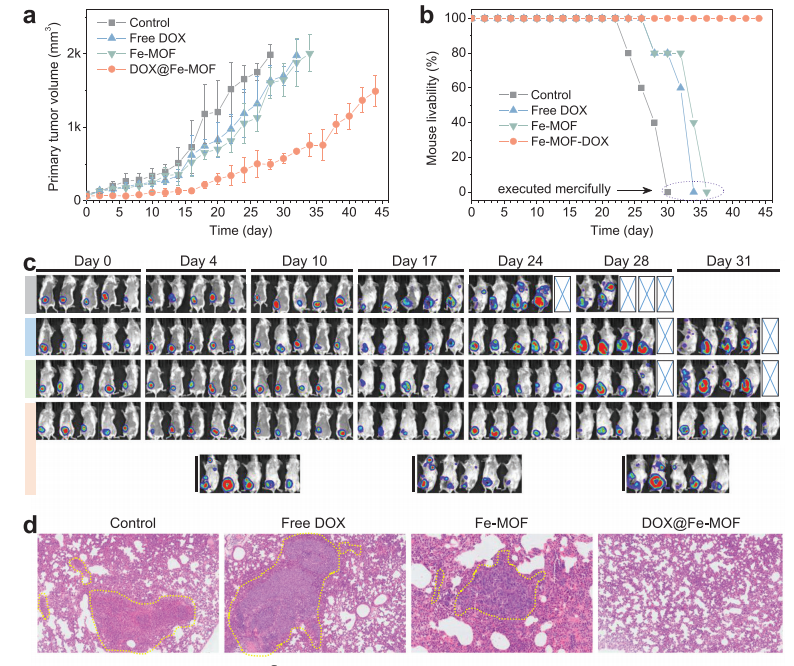

(圖6 DOX@Fe-MOF納米藥物對(duì)原發(fā)性乳腺腫瘤生長(zhǎng)和肺轉(zhuǎn)移的抑制作用)
全文總結(jié)
開(kāi)發(fā)了一種新型的Fe-MOF納米晶體作為耐多藥和轉(zhuǎn)移的氫聯(lián)合化療的藥物載體和氫供體。所構(gòu)建的DOX@Fe-MOF納米藥物具有優(yōu)異的酸響應(yīng)降解和氫/藥物釋放行為。納米藥物釋放的氫氣通過(guò)下調(diào)P-gp表達(dá)和降低ATP水平,增強(qiáng)ROS介導(dǎo)的DNA損傷,有效增敏MCF-7/ADR細(xì)胞的化療,并通過(guò)免疫激活M1巨噬細(xì)胞和抑制MMP-2表達(dá),輔助DOX有效抑制轉(zhuǎn)移。另一方面,納米藥物釋放的氫氣也減少了DOX對(duì)正常組織的毒副作用,使DOX@Fe-MOF納米藥物具有良好的生物相容性和生物安全性。高抗MDR和抗轉(zhuǎn)移效果和高生物安全性得益于DOX@FeMOF納米藥物優(yōu)異的通用性Fe-MOF平臺(tái),保證了其臨床轉(zhuǎn)化的高潛力。
原文鏈接:https://doi.org/10.1002/advs.202101965
僅用于學(xué)術(shù)分享,侵權(quán)請(qǐng)聯(lián)系刪除,歡迎交流。
| 溫馨提示:蘇州北科納米供應(yīng)產(chǎn)品僅用于科研,不能用于人體,不同批次產(chǎn)品規(guī)格性能有差異。網(wǎng)站部分文獻(xiàn)案例圖片源自互聯(lián)網(wǎng),圖片僅供參考,請(qǐng)以實(shí)物為主,如有侵權(quán)請(qǐng)聯(lián)系我們立即刪除。 |
上一篇: 軟骨缺損修復(fù)


